美國的科研人員通過對TTF-1的調控發現,TTF-1能直接調節血管內皮生長因子(VEGF),并且發現VEGF啟動子上有多處TTF-1響應序列。 比如,VEGF的主要受體,VRGFR2顯示出收到TTF-1的直接正調節。本文中顯示,低氧并沒有促進 TTF-1+肺癌細胞中的VEGF的表達。而采用外泌體培養基或者是去外泌體的培養基(EDM)時,TTF-1都能促進VEGF表達。但在研究中意外的發現TTF-1+肺癌細胞的去外泌體培養基(EDM-TTF-1+)能夠內皮細胞的血管形成。
研究人員采用HUVECs,鋪在基質膠上,加入EDM以及VEGFR1等蛋白質后孵育2-3小時,對比不同條件下的分枝數和節點數。
Thyroid Transcription Factor 1 Reprograms Angiogenic Activities of Secretome
L. Wood, N. Cox, C. Phelps, S. Lai, A. Poddar, C. Talbot and D. Mu
Scientific Reports, 2016, 10.1038/srep19857
(一)實驗材料和實驗方法
1)細胞: HUVECs 104 cells/50μl
2)培養基: RPMI
3)基質膠: Basement membrane (Fisher Scientific, CB40234A) 10 µl per well
4) 試劑: A549 conditioned media (EDM)
Recombinant human GM-CSF protein(250ng/ml,Peprotech,300-03)
sVEGFR1 protein(20 ng/ml, RayBiotech,ELH-VEGFR1)
Anti-GM-CSF antibody (R&D systems. MAB215)
Anti-VEGFR1 antibody (R&D systems. AF321)
5)耗材: ibidi血管生成載玻片 (ibidi, 81506)
6)其他: 細格紙
(二)實驗步驟
1)準備基質膠
① 將10μl的Basement membrane以5mg/ml的濃度鋪入ibidi血管生成載玻片的內孔中,注意槍頭要垂直于內孔的正上方加入Matrigel,防止有Matrigel流經上孔而留下殘留膠。
② 蓋上ibidi血管生成載玻片的蓋子。
③ 準備一個10cm的培養皿,放入浸過水的紙巾,制成一個濕盒。
④ 將ibidi血管生成載玻片放入培養皿中,蓋上培養皿蓋。
⑤ 37℃至少孵育30分鐘,使基質膠完全固化。

怎么知道加了合適體積的Matrigel:
由于Matrigel流動性不強,并且有可能移液槍不準確,有可能10μl的膠不能填滿ibidi血管生成載玻片的下孔,這樣,必然會影響到實驗的成像結果。這時用一張格子紙就能知道移液槍調整到多少能正好把下孔填滿。

如上圖所示,垂直透過每個孔看下面的格子紙,如果格子被縮小了,那么就說明膠沒加滿,格子被放大了,那么膠就加多了,格子沒發生什么變形,這才是剛剛加滿下孔的狀態。
3)鋪細胞
① 在培養好的HUVECs細胞的60mm培養皿中加入5μg 的 Calcein-AM,染色45分鐘。
② 胰酶消化細胞制成懸液,每孔種10000個細胞即可。準備密度為2*105cells/ml的細胞懸液,充分混勻。
③ 將膠已經凝固的ibidi血管生成載玻片從濕盒中取出。
④ 每孔加入50μl的細胞懸液,注意保持槍頭垂直在上孔的上方,不要接觸下孔的凝膠。可以使用排槍。
⑤ 同樣用格子紙查看是不是加了足夠量的液體,如果沒有,加入無細胞的培養基,使上孔液體正好加滿。
⑥ 蓋上蓋,靜置,一段時間后,所有細胞都會沉下去落在Matrigel的表面。

4)不同培養基處理
采用EDM-EV,EDM-HDD,EDM-TTF-1處理細胞,并分別加入 rGM-CSF和rsVEGFR1,以Goat Ab和 Mouse Ab作為對照。37℃,培養2-3小時。
5)采集圖像并統計結果
使用尼康TS100顯微鏡的40倍鏡采集圖像,并且用 ImageJ對其分枝數和節點數進行測量和統計。
三)實驗結果
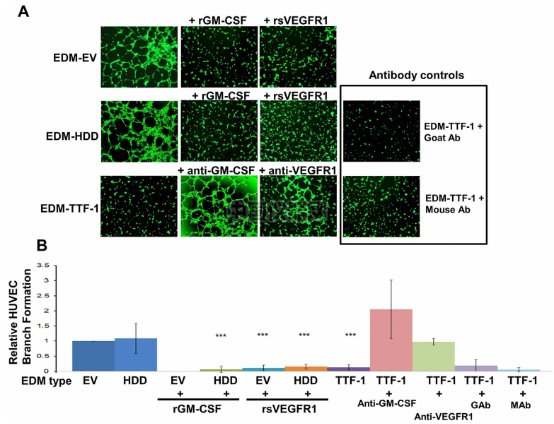
如圖所示,使用EDM-TTF1處理的HUVECs血管生成被顯著的壓制。當加入GM-CSF和VEGFR1后,血管生成也被顯著的壓制,但當加入GM-CSF和VEGFR1的抗體后,血管生成的壓制也被取消,細胞又顯出很強的血管生成結果。說明TTF-1上調了GM-CSF和VEGFR1的表達,壓制了血管生成的進程。
|




